血液検査をする時、食事してはいけないの?
プレアルブミン、IgMなど抗原抗体反応により生じた 複合体を光の透過率(TIA)や散乱強度(ネフェロメトリー)で測定する検査
総タンパク、ビリルビンなど吸光度を測定する検査
PT、APTTなどフィブリンの析出を透過光や
散乱光で調べる検査
健常者では食後でも測定に影響が出るほどの乳び血清には通常なりません。RIA、IRMA、EIA、ELISA、CLEIA、FEIA、CLIA、ECLIAなどの測定法は乳び血清の影響を通常受けません
どの採血管と抗凝固剤を使えばいいの?
採血管と抗凝固剤の種類
臨床検査に用いられる採血管は凝固剤が予め入っているものと、そうでないもの(プレーン管)と大別されます。
プレーン管
抗凝固剤が入っていないもの
生化学・内分泌・感染症・自己抗体・腫瘍マーカー検査など
血清分離剤入りの採血管を用いた場合は、血清分離が容易
遠心分離後には上清部分の血清・血漿と下層部分の血球に分かれます。
プレーン管に採血された血液は、採血管内壁との接触により内因系凝固経路が活性化され、通常では室温で約30分間放置すると完全に凝固しますが、この所要時間を10分程度に短縮する目的でプレーン管にはしばしば凝固促進剤が添加されています。プレーン管内で凝固した血液は、遠心操作(3,000回転/分、4℃、5分)により上清部分の血清と下層部分の血餅とに分かれます。血清分離剤入りの採血管を用いた場合は、遠心後に血清と血餅との間に分離剤による隔壁が形成されるため血清分離が容易であり、遠心後の血清を採血管に入れたままの状態で数日間冷蔵保存することも可能です。しかし血清分離剤は種々の薬物を吸着する性質を持っているため、薬物血中濃度測定時には分離剤入り採血管を使用できません。
凝固剤入り

EDTA-2K
血球計数や血液塗抹標本等の 血液学的検査
検体中のカルシウムイオンをキレート除去することで強力な抗凝固作用を発揮します。EDTAは約0.05%の頻度で血小板凝集塊を形成するため、自動血球計数時にはEDTA依存性偽性血小板減少を起こすことがあります。
遠心分離後には上清部分の血清・血漿と下層部分の血球に分かれます。
抗凝固剤入りの採血管に採取された血液は、採血管内での血液凝固反応の進行が阻止され、遠心操作後には上清部分の血漿と下層部分の血球とに分かれます。ちなみに臨床検査に用いられる抗凝固剤をその作用機序で分類した場合、凝固因子の活性化に必要な血中カルシウムイオンを除去するタイプの抗凝固剤と、トロンビン(Ⅱa因子)やXa因子等の活性型凝固因子の作用を抑制するタイプに大別されます。前者としてはエチレンジアミン四酢酸(ethylene diamine tetraacetic acid: EDTA)やクエン酸が代表的であり、後者としてはヘパリンが知られています。カルシウムや鉄等の血中金属イオンは日常検査ではキレート試薬を用いて測定されるため、前者のタイプの抗凝固剤を用いた検体では正しく測定できません。同様に活性化剤として金属イオンを必要とする酵素(アルカリホスファターゼ(ALP)等)についても、前者のタイプの抗凝固剤を用いた検体では正しく測定できません。
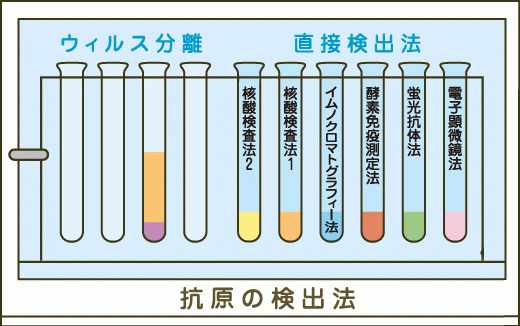
ウイルス性感染症と臨床検査法
近年、抗原検査法などが急速に実用化され、ウイルス性疾患の検査法が進歩してきました。現在実用化されている検査法について簡単に紹介し、主なウイルス性の感染症と検査方法については一覧表に示しました。
主な感染症と検査法の一覧
疾患名 | 病原体 | 抗原の検出 | 抗体の検出 |
|---|---|---|---|
インフルエンザ | インフルエンザウィルス | イムノクロマト法、ウイルス分離 | HI、CF、IIF 試験 |
水痘(水疱瘡) | 水痘帯状疱疹ウイルス(VZV) | DNA(プローブ法)、IFA、ウイルス分離 | CF、NT、EIA、IAHA 試験 |
麻疹(はしか) | 麻疹(ミーズルス)ウイルス | RNA(プローブ法)、ウイルス分離 | HI、CF、NT、EIA、PHA 試験 |
風疹 | 風疹(ルベラ)ウイルス | RNA(プローブ法)、ウイルス分離 | HI、CF、NT、EIA、IIF、PHA 試験 |
おたふくかぜ | 日本脳炎(JE)ウイルス | RNA(プローブ法)、ウイルス分離 | HI、CF、NT、EIA 試験 |
日本脳炎 | 日本脳炎(JE)ウイルス | RNA(プローブ法)、ウイルス分離 | HI、CF、NT、IIF 試験 |
AIDS | HIV | RNA(プローブ法)、EIA、ウイルス分離 | IIF、EIA、PA、WB 試験 |
ウイルス性肝炎 | HBV、HCV 他 | DNA、RNA(プローブ法)、EIA | EIA、PHA、IAHA 試験 |
ノロウイルス感染症 | ノロウイルス | 電顕法、PCR法、EL I SA法 | - |
冬季小児下痢(白痢) | ロタウイルス | E I A、LA、RPHA、イムノクロマト法 | CF 試験 |
狂犬病(狂水症) | 狂犬病ウイルス | ウイルス分離 | CF、IIF 試験 |
急性灰白髄炎 | ポリオウイルス | RNA(プローブ法)、ウイルス分離 | CF、NT 試験 |
SARS | コロナウイルス | PCR法、LAMP法、ウイルス分離 | ELISA、IFA、NT 試験 |
手足口病 | コクサッキー、 エンテロウイルス | RNA(プローブ法)、ウイルス分離 | HI、NT、CF、IIF 試験 |
単純ヘルペス(口唇、性器) | ヘルペスウイルス | DNA(プローブ法)、IFA、ウイルス分離 | CF、NT、IIF、EIA、PHA 試験 |
伝染性単核症、上顎頭癌 | EBウイルス | DNA(プローブ法) | IIF、EIA 試験 |
成人T細胞白血病(ATL) | HTLV-1 | DNA(プローブ法) | IIF、EIA、PA、WB 試験 |
サイトメガロ感染症 | サイトメガロウイルス | DNA(プローブ法)、IFA、EIA、ウイルス分離 | CF、IIF、EIA 試験 |
腎症候性出血熱(HFRS) | ハンタウイルス | - | IIF、EIA、IAHA 試験 |
突発性発疹 | HHV6 | ウイルス分離 | FA、EIA 試験 |
検体の採取と保存方法
検体の保存法に疑問がある場合は、時間内は各検査室へ直接ご連絡ください。 また時間外は時間外緊急検査担当者へご相談ください。
検体採取に関する注意
微生物検査における検体採取についての注意点
検体は適切に採取し適切な方法で提出しましょう
微生物検査は、特に採取検体の良否が成績の品質を大きく左右します。今回は提出頻度の高いいくつかの検体について、提出の注意点を簡単に記述しました。特殊な検査材料や詳細については検査案内書あるいは成書などをご参照下さい。尚、具体的なご質問につきましては、お気軽に微生物検査室又は微生物検査担当技師にお尋ね頂く事をお勧め致します。
血液
最近は、培養を自動培養装置で行い、菌の発育によるCO2の検出などで陽性の感知を行う様になってきていますので、血液培養専用のボトルで提出します。好気性菌用・嫌気性菌用と2本がセットになっている物が多い様です。ボトルには培養に適したガスを充填してあるものがあり、不用意に何度も注射針を刺し入れると、ガスが抜けてしまう恐れがあります(使用しておられる血液培養ボトルをよく確認して下さい)。
喀痰
一般的に、早朝起床時の自然喀出痰が、病原微生物の検出に適していると言われています。出来れば、口をゆすいでから採取することをお勧めします。唾液やうがい液では病原微生物の検出が難しい場合があります。膿性の部分や、血性の部分がある場合は、出来るだけその部分を提出して下さい。提出用の容器は、口の小さいものが多いので、採取の際には滅菌シャーレなどに喀出してから滅菌スポイトなどで容器に入れる様にしている施設もあります。冷蔵保存で提出します。
尿
新鮮な中間尿を清潔な容器(出来れば滅菌容器)に採取したものを、滅菌スピッツに10mL程度、出来るだけ無菌的に入れて提出します。 膀胱炎などで一般的な起因菌を検出する目的の場合は、検体を冷蔵で提出しますが、淋菌を目的とする様な場合は、なるべく体温に近い温度で保温して提出して下さい。淋菌は温度変化に弱く、搬送中に死滅してしまう恐れがあるからです。出来れば、淋菌など目的菌を依頼書に記入※しておけば、搬送温度などに注意出来ますので、病原菌が検出され易くなると思います。
※目的菌がはっきりしていると検出までの検査時間が短縮されます。
また、微生物検査は特に、依頼書の中の患者情報の記載が多いほど正確に検査が行えます。是非、より多くの患者情報を検査室に与えて下さい。
膿
化膿創の場合など微生物の感染の可能性が高いと考えられます。 特に、閉鎖された部位からの検体については、嫌気性菌が分離される可能性がありますので、検体搬送の容器について、嫌気性菌も保存搬送可能な容器で提出する必要があります。 通常冷蔵で提出します。
膣分泌物
膣炎、B群連鎖球菌、STDなどについて病原微生物の検査が行われます。綿棒と培地が一緒になった、検体採取容器で採取後通常冷蔵で提出します。
便
感染性腸炎、偽膜性大腸炎、寄生虫などの原因微生物について検査します。便実質で提出される事が多いですが、嫌気性菌やウイルスの検査には、特殊な提出容器や提出方法が必要な場合がありますので、注意が必要です。お気軽に検査室(検査センター)にお尋ねください。
ホルモンおよび腫瘍マーカーの測定における検体採取の注意点
血液検査及び凝固検査における検査前過誤の要因

採血手段
血液検査及び凝固検査用検体は、「JCCLS標準採血法ガイドライン」に準拠して静脈穿刺により採取するのが一般的である。
・採血時の溶血を防止する為、23Gより細い注射針は使用しない。
・駆血時間が長引くと血液凝固反応が活性化する為、原則として駆血後2分以内に採血を終了する。なお、検査項目(血小板第4因子、βトロンボグロビン等)によっては駆血帯を使用せずに採血する方が望ましい。
・検体に組織液が混入すると血液凝固反応が活性化するため、注射針の先端が確実に血管内へ挿入された状態で採血すべきである。
・特にTAT検査は、採血時の不具合により偽陽性となることが多い。

凝固剤及び採血管
一般血液検査(血球数算定など)用抗凝固剤としてはEDTA-2K、凝固検査用抗凝固剤としてはクエン酸Naが最も多く用いられる。いずれの抗凝固剤が入った採取用試験管も検体注入後5回以上穏やかに転倒混和する。混和不十分の場合には凝血塊や血小板凝集塊が形成され、過度の激しい混和では溶血が生じる。
- ・EDTAはキレート作用により好中球アルカリホスファターゼ(NAP)を失活させる為、NAPスコアの判定には適さない。
- ・ヘパリンは血小板凝集を起こすため、自動血球計数機で測定すると血小板数が1/2~1/3に減少することがある。
- ・凝固検査用検体は9:1の比率で全血とクエン酸Naを混和するのが原則であるが、概ね規定量の±10%以内であれば許容範囲内である。検体量が少ない場合や多血症検体(ヘマトクリット55%以上)では被検血漿に対して相対的にクエン酸Na濃度が高くなる為、各種検査結果は総じて低値(凝固時間では延長)となる。
- ・血清FDPの測定には専用採血管が必要である(血漿FDPは一般的な凝固検査用採血管で検査可能である)。

各種薬剤の影響
・点滴チューブから採取した血液検体は輸液により希釈されている可能性がある。※
・ヘパリンの混入はAPTT延長等の凝固検査結果異常を来すため、特にヘパリンロック部位からの採血時にはヘパリンの混入がないよう注意を要する。
・脂肪乳剤の混入した検体では、自動血球計数機で白血球偽性高値となる場合がある。
※生化学検査でも希釈による測定値の低下が起きるが、輸液の内容によっては、測定値が高値となる場合(糖・電解質など)がある。

検体保存とその後の処理
・蒸発による検体濃縮を避けるため、密閉・密栓した容器に保存する。
・血液検査用検体は室温保存が一般的である。冷蔵保存では寒冷凝集素やクリオグロブリンが測定値に影響を及ぼす場合があり、凍結保存では溶血をきたす。
・EDTA入り採血管では室温保存約4時間で単球や好中球の形態変化(空砲形成、顆粒減少等)が目立つようになるため、末梢血塗抹標本は採血後4時間以内に作成する。※
・凝固検査用検体は採血後1時間以内に4℃で遠心分離し、乏血小板血漿(ループスアンチコアグラント測定時は血小板数1万/μLcdが理想的)にして測定時まで冷凍保存するのが一般的であったが、採血後4時間以内(PTは24時間以内)に検査が出来る場合にはプロトロビン時間(PT)測定用の検体は室温保存が推奨されている。測定が翌日以降になる場合には-80℃で凍結保存する(凝固第Ⅴ因子及び第Ⅷ因子は特に室温では不安定である)。
※4時間以上経過して作成した末梢血塗抹標本の成績は参考値と心得る。
<参考資料>
臨床病理特集第103号;検体検査のサンプリングー検査前過誤防止のためにー1996年。
Medical Technology第29巻臨時増刊;これだけはやってはいけない臨床検査禁忌・注意マニュアル2001年。
JCCLS;標準採血法ガイドライン2004年。
ALT活性測定用血清検体の保存条件に関する検討
山内昭浩,青木哲雄*
東海市民病院中央臨床検査科,*常滑市民病院中央検査科
医学検査, 45(5) : 896-899, 1996.
CA125の保存条件による変動の機構についての検討
青野悠久子,山口ひろ子,荒井由貴子,橋本佳明,中原一彦,福岡秀興*,内村英正**
東京大学,**杏林大学,*検査部医学部発達医科学,**医学部臨床病理学
臨床病理, 47 : 341, 1999.
PCR法、RT-PCR法における抗凝固剤および検体保存の影響について
川淵靖司*, 藤木淳子*, 藤井留美*, 大備美紀*, 小林重己**, 山形篤志**, 阿部恵美子**, 杉本徹**
*海外勤務健康管理センター, **横浜労災病院
医学検査, 48(4) : 732, 1999.
血算,形態検査に用いる検体は凍結保存してはならない
寺澤儀男
青森県立中央病院臨床検査部
Medical Technology, 29(13) : 1472, 2001.
血清HDL-コレステロールの保存安定性
眞部正弘1), 杉内博幸1), 入江徹美2), 永田四郎1), 安東由喜雄1), 岡部紘明1)
1)熊本大学医学部附属病院中央検査部, 2)熊本大学大学院医学薬学研究部薬剤情報分析学分野
日本臨床検査自動化学会会誌, 29(4) : 368, 2004.
血清保存が血中HCV-RNA定量値におよぼす影響について
神野智美, 高井良美智代, 沼田早苗, 佐藤悦子, 高橋明子, 大田喜孝
雪の聖母会聖マリア病院臨床検査部
医学検査, 52(8) : 1063-1066, 2003.
検査の保存・搬送
山舘周恒
日本大学板橋病院臨床検査部
Medical Technology, 22(3) : 217-221, 1994.
検査の保存・搬送
佐守友博,松村忍
日本医学臨床検査研究所
Medical Technology, 22(3) : 222-227, 1994.
検体採取後室温放置してはならない(遊離コレステロール,LCAT,NEFA,アポ蛋白AI・B,アルドラーゼ)
山舘周恒
日本大学医学部附属板橋病院臨床検査部
Medical Technology, 29(13) : 1510-1511, 2001.
検体採取容器と検体の保存
西山宏幸
駿河台日本大学病院臨床検査部
臨床と微生物, 27(3) : 335-344, 2000.
検体の採取・輪送・保存・塗抹・染色・鏡検
編集部
東京都
臨床病理レビュー, (134) : 1-8, 2006.
検体の長期間の放置は避けるべきである
上野一郎
信州大学医学部附属病院中央検査部
Medical Technology, 29(13) : 1613, 2001.
検体の保存条件の相違における測定値変動 2.全血検体冷蔵保存(プレーン・ヘパリン・EDTA-2K採血管)
関東甲信地区臨床化学検査研究班, 山口純也1), 葛西俊二2), 神山清志3)
1)済生会川口総合病院臨床検査科, 2)芳賀赤十字病院, 3)浦和医師会メディカルセンター
日本臨床検査自動化学会会誌, 31(4) : 504, 2006.
検体の保存条件の相違における測定値変動 3.血清・血漿(ヘパリン)検体の冷蔵・室温保存
関東甲信地区臨床化学検査研究班, 二瓶司1), 篠崎一也1), 高柳美伊子2), 及川仁3), 山口純也4), 神山清志5)
1)総合守谷第一病院検査部, 2)筑波メディカルセンター病院, 3)筑波大学附属病院, 4)済生会川口総合病院, 5)浦和医師会メディカルセンター
日本臨床検査自動化学会会誌, 31(4) : 505, 2006.
検体の保存条件の相違による測定値変動 1.全血検体室温保存(プレーン・ヘパリン・EDTA2K採血管)
関東甲信地区臨床化学検査研究班, 神山清志1), 宮崎洋道2), 五十嵐信吾2), 井田伸一2), 井口智之2), 志村さな江3), 伊藤甲子生3), 新勝典4), 町田哲男5), 山口純也6)
1)浦和医師会メディカルセンター, 2)群馬県健康づくり財団, 3)館林厚生病院, 4)伊勢崎佐波医師会病院, 5)群馬大学医学部附属病院, 6)済生会川口総合病院
日本臨床検査自動化学会会誌, 31(4) : 503, 2006.
検体の保存条件の相違による測定値変動 4.血清・血漿(ヘパリン)検体の-30℃・-80℃保存
関東甲信地区臨床化学検査研究班, 奥住裕二1), 永野雄二2), 茂木孝一3), 沼野剛4), 中村道子5), 山口純也6), 神山清志7)
1)獨協医科大学越谷病院, 2)深谷赤十字病院, 3)深谷市・大里郡医師会メヂカルセンター, 4)埼玉県立小児医療センター, 5)東松山医師会病院臨床検査センター, 6)済生会川口総合病院, 7)浦和医師会メディカルセンター
日本臨床検査自動化学会会誌, 31(4) : 506, 2006.
濾紙血を用いた前立腺特異抗原(PSA)測定検体の安定性に関する検討
宇藤俊明, 立川忠幸, 鈴木明, 青木哲雄
社団法人半田市医師会健康管理センター
医学検査, 53(4) : 594, 2004.
検体の保存によるCA125測定値の上昇について
阿部正樹,久保敬信,須藤由美,堀田一美,堂満憲一,村崎義紀
慈恵医大第三病院中央検査部
医学検査, 45(3) : 456, 1996.
検体保存および容器による検査値への影響
高須幸一, 高橋雄二郎
日本医学臨床検査研究所
京臨技会誌, 23(3) : 177-184, 1996.
検体保存条件が検査データに及ぼす影響
山内昭浩1,宇藤俊明2,青木哲雄2
生物試料分析, 28(1) : 53, 2005.
検体保存と抗凝固剤
常名政弘
東京大学医学部附属病院検査部
Medical Technology, 30(7) : 787-792, 2002.
自動血液分析装置MAXMで得られる白血球分類値に対する検体保存の影響
津田泉, 巽典之
大阪市立大学医学部臨床検査医学
日本臨床検査自動化学会会誌, 17(5) : 605-607, 1992
全血検体の保存状態による電解質および代謝項目の経時変化の検討
真茅孝志,杉原学*,鶴田千之*,戸畑裕志*,上田直行**,加納龍彦**
久留米大学中央手術部,*久留米大学臨床工学センター,**久留米大学麻酔学教室
日本手術医学会誌, 23(1) : 47-49, 2002.
全血放置後の臨床検査値の変動における温度条件と個体差
河口勝憲,市原清志,小野聡子,三宅知子
川崎医科大学附属病院中央検査部
医学検査, 45(8) : 1270-1275, 1996.
前立腺性酸性ホスファターゼ(PAP)および前立腺特異抗原(PSA)の検体保存条件による安定性に関する検討
石橋みどり*1, 渡邊清明*1, 加野象次郎*2
*1慶應義塾大学医学部中央臨床検査部, *2東京逓信病院臨床検査部
泌尿器外科, 11(8) : 916-920, 1998.
体保存条件による凝固スクリーニング検査の影響と試薬間差
中村由紀,山崎徹也,河南尚寛,早川幸浩
板橋中央総合病院研究所
医学検査, 45(3) : 531, 1996.
当協議会発出の各種検査のガイドライン・考え方
「我が国におけるLaboratory Developed Test(LDT)の枠組みと 臨床実装における課題に関する考察」(2024年3月発行)
先進医療技術で実施されている検査や病理検査等の中には、未承認体外診断用医薬品を用いた検査をLaboratory Developed Test(LDT)として臨床応用されているものがあります。一方で、本邦においてはLDTの性能、品質並びに安全性を確認する仕組みがなく、また、LDTの捉え方・考え方に関しては、医療関係者の間でも定まっていないと考えられます。
我が国の国民皆保険制度の下で先進的検査を臨床実装していくためには、LDTに関する議論を避けては通れないと考え、当協議会はLDTに関するワーキンググループを設置し、「我が国におけるLDTの枠組みと臨床実装における課題」に取り組むことにしました。
今般、我が国におけるLDTの枠組みと臨床実装における課題を整理した文書を作成しましたので、当ホームページに掲載します。
(一社)日本臨床検査振興協議会
LDTに関するワーキンググループ
「我が国におけるLaboratory Developed Test(LDT)の枠組みと 臨床実装における課題に関する考察」へのリンクはコチラ
「遺伝子関連検査の質保証に関する基本的考え方、特に外部精度評価に関して 」(2023年3月発行)
検体検査を行う場合、導入時の分析法の妥当性確認・検証、内部精度管理(IQC)、外部精度評価(EQA)が重要です。
このたび、当協議会 医療政策委員会 遺伝子関連検査に関する小委員会では、遺伝子関連検査の質保証に関する基本的考え方を、EQAに重点をおいてまとめました。
ぜひ、ご活用ください。
(一社)日本臨床検査振興協議会
医療政策委員会
遺伝子関連検査に関する小委員会
「遺伝子関連検査の質保証に関する基本的考え方、特に外部精度評価に関して 」へのリンクはコチラ
別添資料(1)リアルタイムPCRにおける外部精度評価の参考資料へのリンクはコチラ
別添資料(2)NGSにおける外部精度評価の参考資料へのリンクはコチラ
「精確な臨床検査値の共有化:現状と問題点」(2022年10月発行)
臨床検査は診療において客観的な情報を提供する不可欠なものであり、臨床検査の値は、精確(精密で正確なこと)で施設間の差が小さいものとして共有されるべきものです。
今般、当協議会では医療従事者ならびに臨床検査値の利活用に関わる職種の方々を主な対象とし、現在 精確な臨床検査値の共有化が可能となっている項目、及び、そうでない項目を示し、さらに共有化に向けてどのような取り組みがなされているか、その問題点は何かなどにつき解説した文書を取りまとめました。
臨床検査値の円滑な利活用に役立つことを期待しております。
(一社)日本臨床検査振興協議会
「大規模災害対策規程」の公開に関して(2022年4月制定)
日本臨床検査振興協議会では、大規模災害(暴風、 竜巻、豪雨、豪雪、洪水、崖崩れ、土石流、高潮、地震、津波、噴火、地滑りその他の異常な自然現象、大規模事故により生ずる被害が発生した場合)が発生した際、会員間の連携を促進することにより、行政等と連携し医療機関の要請に応え、国民の安全を確保するとともに、健康を維持することを目的とし、大規模災害対策規程を2022年4月に制定しました。
大規模災害発生時に際しては、本協議会加盟団体は本規程に則り活動を行います。ぜひご確認ください。
日本臨床検査振興協議会
大規模災害対策委員会
リキッドバイオプシーによる循環血中の腫瘍由来DNA(circulating tumor DNA; ctDNA)検査の質保証に関する見解(2022年3月発行)
がん組織を採取できなくても、採血した血液中にあるがん由来DNAを調べることで、治療方法を選択したり、治療効果を判定したりすることができる、通称リキッドバイオプシーの活用が進められています。昨年(2021年)には保険適用もされました。しかしながら、血液中のがん由来DNAの量はごくわずかで、検査の質を保証するためには注意すべきことがたくさんあります。私どもは、すべての臨床検査を診療に役立てていくためには、正確かつ精密に行い、質の確保された臨床検査を実施していくことが重要と考えております。
このたび、リキッドバイオプシー検査を適正に行うための留意点をまとめました。ぜひ、ご活用ください。
臨床検査振興協議会
医療政策委員会
遺伝子関連検査に関する小委員会
「ctDNA検査の質保証に関する見解」へのリンクはコチラ
表1ctDNA検査の留意点へのリンクはコチラ 表2ctDNA検査の分類へのリンクはコチラ 表3採血管と標準物質へのリンクはコチラ
ctDNA検査に関する参考資料はコチラ
がん遺伝子パネル検査の品質・精度の確保に関する基本的考え方 (第 2.1 版)
文書へのリンクはコチラ